elastina este o proteină structurală care este implicată în construirea țesutului conjunctiv al plămânilor, vaselor de sânge și pielii. Spre deosebire de colagen, care se găsește și în țesutul conjunctiv, este foarte elastic. Rețeaua de molecule de elastină una cu cealaltă în zona extracelulară.
Ce este elastina?
Toate vertebrele conțin fibra de proteină elastină. Este o proteină structurală care este responsabilă de conturarea unor organe atât de importante precum plămânii, vasele de sânge sau pielea. Împreună cu colagenul, formează țesutul conjunctiv al acestor organe.
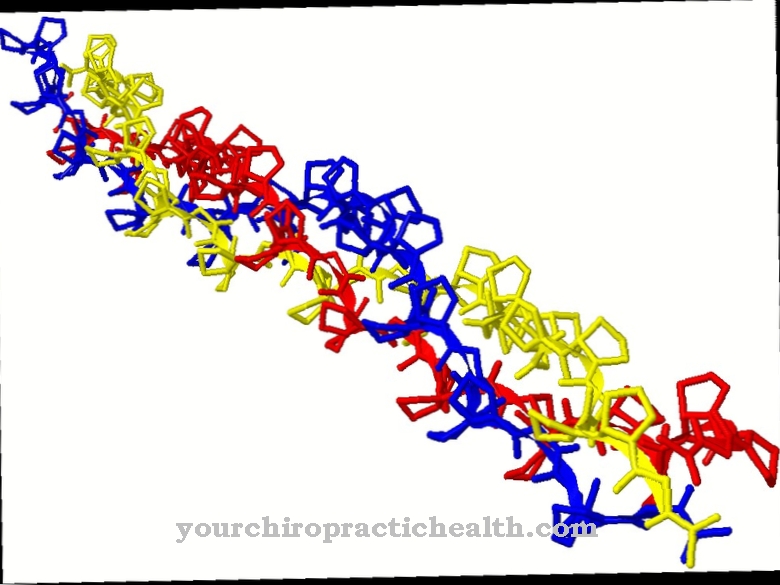
Proprietățile elastinei și colagenului se completează reciproc. Elastina, după cum sugerează și numele, este foarte elastică în contrast cu colagenul. Acest lucru face ca țesutul conjunctiv al pielii, plămânilor și vaselor de sânge să fie elastic și maleabil. Funcțiile acestor trei organe necesită redimensionare constantă. Elastina este compusă în principal din aminoacizi alanină, glicină, prolină, valină, lizină, leucină și izoleucină. Zonele hidrofobe și hidrofile alternează în interiorul moleculei.
Unitățile caracteristice ale celor patru aminoacizi alanină, prolină, glicină și valină sunt repetate în fiecare domeniu hidrofob. Zonele hidrofile au în principal lizină. Reziduul de lizină este oxidat la allysine de enzima lisil oxidază. Grupa amino terminal este înlocuită cu o grupare carboxil. Reziduurile de lizină ale diferitelor lanțuri proteice se combină între ele pentru a forma o desmosină în formă de inel și, astfel, a lega încrucișarea diferitelor lanțuri unele cu altele.
Funcție, efect și sarcini
Ca proteină structurală în țesutul conjunctiv, elastina are sarcina de a asigura forma și elasticitatea plămânilor, vaselor de sânge și a pielii. Toate cele trei organe sunt dependente de flexibilitatea țesutului conjunctiv. Acestea sunt supuse unor modificări constante de volum.
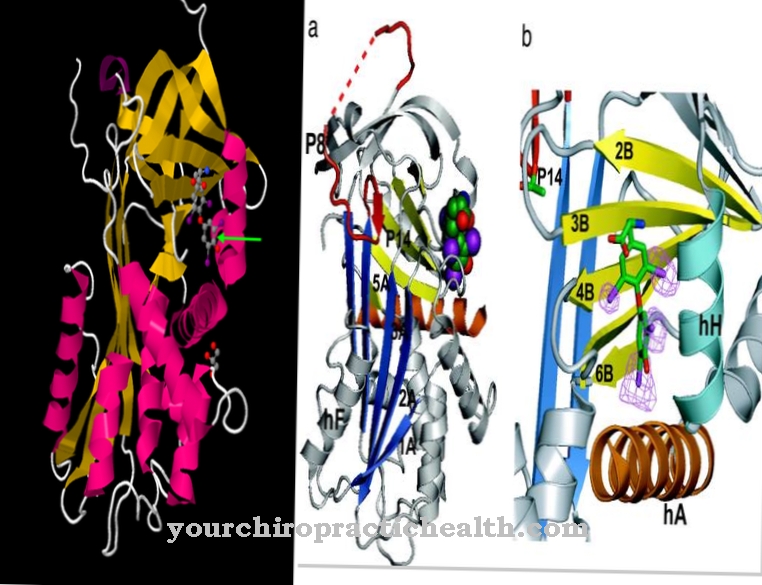
Ca o proteină structurală, țesutul conjunctiv are în mare parte colagen. Este rezistent la rupere, dar ar fi prea rigid ca unic element structural. Doar combinația dintre proprietățile elastinei și colagenului permite țesutului conjunctiv să devină elastic și, în același timp, rezistent la rupere. Blocul de bază al elastinei este tropoelastina. Tropoelastina este compusă din domenii hidrofobe și hidrofile alternative. Are o masă moleculară aproximativă de 72 de kilodaltoni. Rețeaua de unități tropoelastine una cu alta la reziduurile de lizină.
În timp ce tropoelastina este solubilă în apă datorită numeroaselor sale domenii hidrofile, solubilitatea în apă a polimerului reticulat este anulată. Tropoelastina se formează în interiorul celulelor și ajunge în zona extracelulară prin transportul membranei. Aici are loc rețeaua blocurilor de bază, cu unități de desmosină în formă de inel formate în punctele de rețea. Trei reziduuri de alilină și un rezidu de lizină participă întotdeauna la formarea desmosinei. Deoarece allysina este un produs de oxidare a lizinei, patru reziduuri de lizină sunt legate în cele din urmă între ele.
Această formă de legătură conferă elastinei elasticitatea sa specială. Reticularea protejează, de asemenea, elastina de denaturare și degradare de aproape toate proteazele. Cu toate acestea, enzima elastază este o excepție, fiind singura proteză capabilă să descompună elastina. În acest fel, elastinele ingerate prin alimente sunt defalcate.
Educație, apariție, proprietăți și valori optime
După cum sa menționat deja, elastina este o componentă necesară a țesutului conjunctiv al plămânilor, vaselor de sânge și pielii. Acest lucru afectează toate vertebrele. Tropoelastina bloc de bază poate fi detectată cu greu în țesutul animal. După transformarea reziduurilor de lizină în allysine de lisil oxidază, trei reziduuri de allysine sunt imediat reticulate cu un rezidu de lizină. Elastina apare aproape exclusiv în forma sa în rețea.
Cu toate acestea, detectarea tropoelastinei în experimentele pe animale prin inhibarea sintezei lisiloxazei a avut succes. Dacă această enzimă lipsește, nu are loc conversia lizinei în allysine și, prin urmare, nici o formare de elastină. Datorită rezistenței elastinei la descompunerea proteazelor, pielea, plămânii și vasele de sânge sunt protejate în mod ideal. Efectul degradant al elastazei este limitat de inhibitori de elastază.
Boli și tulburări
Mutațiile genei ELN pot provoca boli ereditare în care structura elastinei este modificată. În așa-numita dermatochalază, există modificări ale țesutului conjunctiv, care se manifestă într-o piele inelastică, înfiorătoare, care se afundă în pliuri.
Boala poate fi dobândită și ereditară. Se observă grupuri familiale. Pe lângă multe alte simptome, această slăbiciune a țesutului conjunctiv apare și în sindromul Williams-Beuren. Aceasta este, de asemenea, o anomalie structurală ereditară a elastinei. Cauza acestei boli este o mutație a cromozomului 7. Mai mult, există și o stenoză aortică congenitală, care se bazează pe o perturbare a structurii elastinei. Artera principală a inimii este îngustată. Fluxul de sânge din ventriculul stâng în fluxul sanguin este întârziat.
Insuficiența cardiacă apare pe termen lung. Cinci până la șase la sută din toate defectele cardiace congenitale sunt stenoze aortice congenitale. Unele forme ale sindromului Ehlers-Danlos sunt de asemenea presupuse a fi malformații cu elastină. Această boală se caracterizează printr-o piele supraestimabilă, care se numește piele de cauciuc. Slăbiciunea țesutului conjunctiv afectează multe organe, inclusiv inima și tractul digestiv. Sindromul este de obicei moștenit ca o trăsătură dominantă autosomală.
În așa-numitul sindrom Menkes, pe lângă multe alte simptome, există și un țesut conjunctiv slab, a cărui cauză se regăsește într-o sinteză tulburată de elastină. De fapt, sindromul Menkes se caracterizează printr-o perturbare a absorbției cuprului în organism. Cu toate acestea, cuprul este un cofactor pentru multe enzime. Printre altele, aceasta include și liziloxidaza. Fără cupru, enzima este ineficientă. Conversia reziduurilor de lizină în alizină nu mai are loc. Drept urmare, reticularea reziduurilor de lizină către desmosină nu mai poate funcționa.



.jpg)

.jpg)
.jpg)
.jpg)




.jpg)