cataliză corespunde reducerii energiei de activare necesare reacțiilor chimice și biologice. Reducerea catalitică a cantității de energie necesară este posibilă de un catalizator care corespunde unei enzime din biologie. În bolile enzimatice, proprietățile catalitice ale enzimelor pot fi reduse sau chiar abolite.
Ce este cataliza?

Enzimele au sarcini speciale în corpul uman. Oricât de diferită poate fi funcția enzimelor individuale, toate au aceeași sarcină și au proprietăți similare pentru a îndeplini această sarcină. Sarcina principală a tuturor enzimelor este cataliza. Prin urmare, biochimia spune că au proprietăți catalitice.
Tradus literal, cataliză înseamnă „dizolvare”. Focusul catalizei este energia de activare. Ca atare, chimia descrie cantitatea de energie care este absolut necesară într-un sistem de reacție pentru reacția chimică a ambilor parteneri de reacție. Catalizatorii sunt folosiți pentru a reduce energia de activare și astfel permite ambilor reactanți să reacționeze în sistemul de reacție chiar și la energii reduse. În sistemele de reacție biologică, enzimele cu proprietăți catalitice reduc energia de activare a unei anumite reacții chimice și funcționează în consecință ca catalizatori chimici.
În contextul unei catalize, pe de o parte, probabilitatea unui proces de reacție de succes crește și, pe de altă parte, viteza reacției crește uneori. O modificare a echilibrului chimic nu are loc în contextul catalizei.
Chimia distinge cataliza omogenă de cataliza eterogenă. Biocataliza nu corespunde nici unei forme, nici celeilalte forme. Este o formă independentă de cataliză.
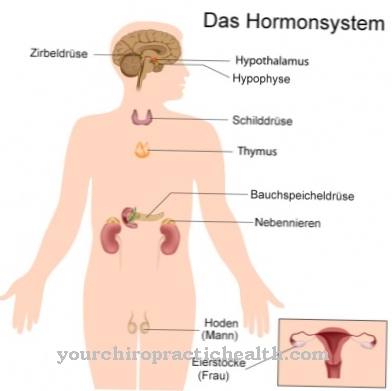
Funcție și sarcină
Biocataliza corespunde controlului, implementării sau accelerării reacțiilor chimice într-un mediu biologic. Enzimele acționează ca catalizatori biologici în acest proces. Fiecare enzimă constă în mare parte din proteine, unele dintre ele fiind asociate cu un co-factor. Aproape toate reacțiile biochimice din organismele vii au un catalizator enzimatic.
Biocataliza este implementată în biotehnologie folosind enzime izolate sau vii. Un exemplu de biocataliză poate fi găsit în fabricile de bere, unde procesele biocatalitice sunt implementate folosind bacterii, ciuperci sau drojdie. Industria farmaceutică folosește biocataliza pentru a obține reacții altfel impracticabile.
În corpul uman, cataliza are loc în mod constant, în care enzimele accelerează anumite reacții. Enzimele sunt relevante pentru metabolismul organismelor, de exemplu, și controlează în mare parte reacțiile biochimice din procesele metabolice. Ele controlează digestia, de exemplu, dar sunt, de asemenea, implicate în transcrierea și replicarea ADN-ului sub formă de polimeraze.
Majoritatea tuturor reacțiilor biochimice ar avea loc într-un organism viu fără enzime într-un ritm neglijabil de lent. Enzimele accelerează atingerea echilibrului chimic fără a schimba nimic în echilibru.
O enzimă are activitate catalitică, deoarece poate scădea energia de activare în reacțiile chimice. Această energie corespunde cantității de energie care trebuie aplicată în avans pentru a iniția o reacție. În timpul reacției, substratul se schimbă în stări de tranziție nefavorabile din punct de vedere energetic. Energia de activare forțează substratul în starea sa de tranziție. Efectul catalitic al enzimelor intervine în acest moment în reacția stabilizând starea de tranziție a substratului prin interacțiuni non-covalente. În acest fel, este necesară o energie semnificativ mai mică pentru a transforma un substrat în starea de tranziție. Din această cauză, substratul se transformă în produsul final al reacției într-o viteză mai rapidă. Cu aceste funcții catalitice, enzimele sunt considerate a fi elementele de nivelare a căii pentru fiecare produs de reacție biochimică.
Boli și afecțiuni
Dacă enzimele mută sau nu mai îndeplinesc rolul catalitic adecvat din alte motive, există consecințe extinse asupra sănătății. Grupul de boli ale bolilor metabolice include diferite tulburări din zona metabolismului intermediar de funcționare. Astfel de tulburări sunt fie congenitale, fie dobândite.
Bolile metabolice variază foarte mult în întinderea și răspândirea lor. Și din punct de vedere clinic se manifestă foarte eterogen. O afecțiune aferentă este, de exemplu, diabetul zaharat cu boală răspândită. Totuși, boli ereditare mult mai rare cu un curs letal se încadrează și în acest grup de boli. Osteopenia și osteoporoza rezultată pot fi, de asemenea, urmărite la boli metabolice.
Majoritatea bolilor congenitale din grupul superordonat de boli metabolice corespund defectelor genetice din diverse enzime. În funcție de enzima în cauză, funcția sa catalitică și produsul său de reacție, defectele enzimatice sau deficiențele enzimatice pot, de exemplu, să eșueze organele.
Boala Gaucher este o boală metabolică relativ rară și moștenită. În contextul acestei boli, enzima afectată este glucocerebrosidaza sau glucocerebrosidaza. Această enzimă descompune componentele îmbătrânite ale membranei celulare într-un organism sănătos. Boala Gaucher este deficitară în această enzimă importantă. Dacă enzima nu prezintă suficientă activitate, se ajunge la depunerea componentelor de membrană în lizozomi. Până la 200 de mutații ale enzimei au fost documentate până acum în contextul bolii Gaucher. Gradul de activitate enzimatică reziduală depinde de mutația genei codificatoare în cazul individual. Boala poate, de exemplu, să facă ca enzima să eșueze complet. Cu toate acestea, este de asemenea concepută o reducere funcțională slabă a activității enzimatice. Majoritatea pacienților cu boala prezintă manifestări atât ale organelor interne, cât și ale sistemului nervos.


.jpg)








.jpg)