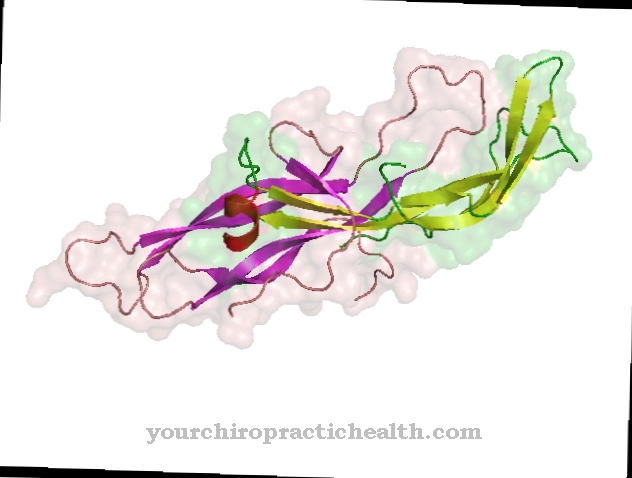
Troponina este un complex format din trei subunități proteice globulare. Ca parte a aparatului contractil al mușchiului, troponina reglează contracția musculară. Este deosebit de importantă în diagnosticarea atacurilor de cord.
Ce este troponina?
Ca o componentă a filamentului de actină, troponina face parte din unitatea contractilă a mușchilor scheletici și cardiaci. Este un complex de proteine globulare care împreună cu F-actina și tropomiozina formează filamentul de actină.
Filamentul de actină, în interacțiune cu filamentele de miozină, permite mușchilor să se contracte. Datorită capacității sale de a începe sau de a opri contracția musculară, troponina este cunoscută ca o proteină reglatoare musculară, pe lângă tropomiozină. Troponina complexului proteic este formată din trei subunități, troponina inhibitoare I, troponina T, care este responsabilă de legarea tropomiozinei și troponina C. de legare a calciului.
Troponina cardiacă joacă un rol important în diagnosticul de urgență al atacurilor de cord. Dacă mușchii cardiaci sunt deteriorați, subunitatea de troponină I este eliberată și poate fi detectată în sânge prin diagnostice de laborator. Aceasta duce la o progresie clasică care îi permite să fie diferențiată de alte tulburări musculare.
Anatomie și structură
Troponina face parte din filamentele de actină care, prin interacțiunea lor cu filamentele de miozină, permite mușchilor să se contracte. Ambele filamente formează cea mai mică unitate contractilă a mușchiului, sarcomerul. Troponina este un complex de proteine globulare care constă din trei subunități.
Se face distincția între troponina inhibitoare (TnI), troponina care leagă tropomiozina (TnT) și troponina care leagă calciul (TnC). Trei peptide troponine urmează regulat șapte molecule de actină F din filament. Ca complex, se află aproape pe orizontală în filamentul actinei. Troponina T leagă tropomiozina pe o parte, care este legată de F-actină și pe cealaltă de troponina I.Troponina I are o afinitate puternică pentru F-actină, astfel încât este legată de ea în starea necontractată. Troponina C se leagă, de asemenea, de troponina I și este expusă la exterior.
Troponina C este cea mai mică dintre subunități și are un domeniu de legare a calciului. În funcție de musculatură, există trei izoforme de troponină I și troponină T. Troponina cardiacă (cTn) se găsește în mușchii inimii și există două troponine diferite (sTn) în mușchii scheletului pentru fibrele musculare scheletice rapide și lente.
Funcție și sarcini
Ca parte a aparatului contractil, troponina joacă un rol important în reglarea contracției musculare. În starea neexcitată, poziția firelor de tropomiozină împiedică atașarea filamentului de actină la capul de miozină. Numai atunci când tropominoza este extrasă mai departe în interiorul helixului de filament de către troponina T este locul de legare pentru miozină expusă. Această schimbare de poziție este obținută printr-o modificare a conformației în complexul de troponină ca urmare a creșterii concentrației de calciu. Calciul este eliberat în fibrele musculare prin excitația electrică a membranei plasmatice.
Troponina C este receptorul de calciu din filamentul de actină, deoarece are un domeniu de legare a calciului. La rândul său, acesta constă din două structuri, fiecare cu patru situri de legare a calciului. Două dintre aceste site-uri de legare sunt fiecare cu înaltă afinitate pentru calciu, două au o afinitate scăzută. Doar site-urile de legătură cu afinitate scăzută sunt implicate în contracție. Schimbarea conformațională de la troponina C la legarea calciului este transmisă direct de troponina T la tropomiozină, care este atrasă mai departe în canelura dintre catenele de actină și eliberează poziția de legare pentru capul de miozină.
În același timp, efectul inhibitor al troponinei I asupra ATPazei este anulat și ATP-ul poate fi împărțit la miozină, astfel încât capul de miozină să clipească. Filamentul de actină este tras de-a lungul filamentului de miozină și contracturile musculare. Legarea miozinei și actinei este întreruptă prin adăugarea de noi ATP la miozină. Nivelul de calciu din fibrele musculare scade, iar firele de tropomiozină ascund din nou locul de legare a miozinei. Mușchiul este în relaxare.
boli
Valoarea troponinei este cel mai important parametru de diagnostic de laborator pentru infarctul miocardic. Dacă mușchiul cardiac este deteriorat, troponina cardiacă, în special troponina T și troponina I, sunt eliberate în sânge. Nivelul de troponină poate fi determinat în ser, plasmă sau sânge întreg.
Concentrația de troponină în sânge arată un curs tipic după un atac de cord, astfel încât poate fi diferențiată de alte afectări ale mușchilor cardiaci. O creștere a troponinei apare la aproximativ 3-8 ore de la debutul atacului de cord. Valorile cele mai mari pot fi măsurate la 12-96 ore de la început. Durează aproximativ două săptămâni pentru ca nivelul de troponină din sânge să revină la normal după un atac de cord. Dacă nivelul troponinei scade, este foarte probabil ca acesta să nu fie un atac de cord, ci o altă cauză, cum ar fi suprasolicitarea, inflamația mușchilor scheletici sau alte leziuni.
Nivelurile crescute de troponină se găsesc, de asemenea, într-o varietate de alte boli care implică distrugerea țesutului muscular. Nivelul troponinei crește, de exemplu, în caz de tulburări funcționale sau inflamații ale inimii, boli ale vaselor de sânge, inflamații sau leziuni ale mușchilor scheletici, accidente vasculare cerebrale, tulburări funcționale ale plămânilor sau chiar arsuri și sepsis. Creșterea troponinei pentru rata mortalității după operații este considerată un factor de risc major. Deoarece există câteva zile între creșterea troponinei și moartea pacientului, medicamentul poate fi intervenit la timp.
Creșterea nivelului de troponină după efortul fizic greoi, cum ar fi sportul de anduranță, nu are valoare de boală. De obicei, valorile se normalizează în câteva ore, astfel încât valoarea normală să revină după maximum 72 de ore.









.jpg)