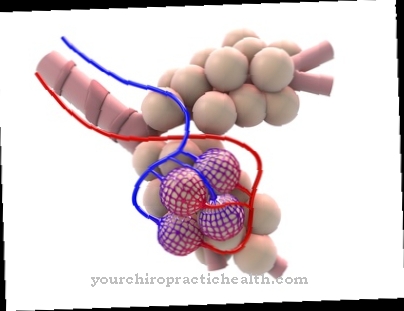
Transfer ARN este un ARN cu lanț scurt, care este compus din 70 până la 95 nucleobaze și, în viziune bidimensională, are o structură asemănătoare trifoiului cu 3 - 4 bucle.
Pentru fiecare dintre cei 20 de aminoacizi proteinogenici cunoscuți, există cel puțin 1 ARN de transfer care poate prelua aminoacizii „săi” din citosol și îl fac disponibil pentru biosinteza unei proteine de pe un ribozom al reticulului endoplasmatic.
Ce este Transferul ARN?
ARN de transfer, cunoscut ca internațional ARNt prescurtată, constă din aproximativ 75 până la 95 nucleobaze și, din perspectiva planului bidimensional, este o reminiscență a unei structuri asemănătoare unui trifoi, cu trei bucle neschimbabile și o buclă variabilă și tulpina acceptantă a aminoacidului.
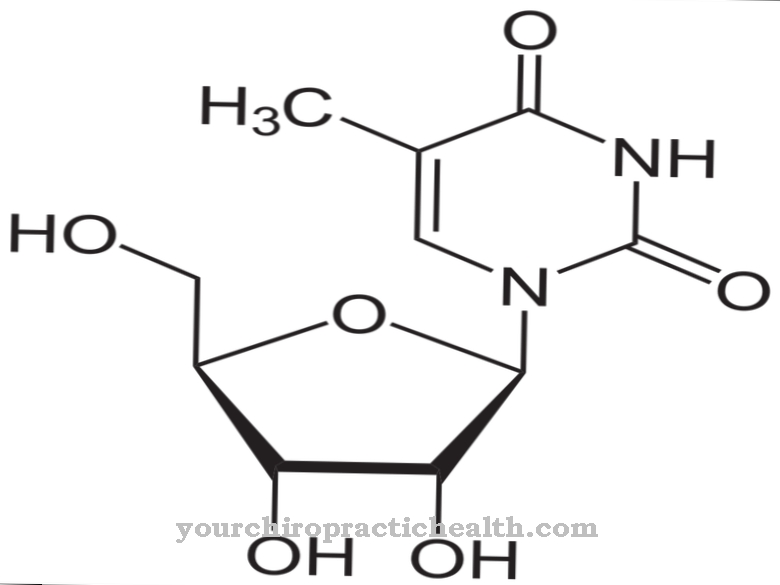
În structura terțiară tridimensională, o moleculă de ARNt seamănă mai mult cu o formă de L, cu piciorul scurt corespunzător tulpinii de acceptare și piciorul lung la bucla anticodon. Pe lângă cele patru nucleozide neschimbate adenozina, uridina, citidina și guanozina, care formează, de asemenea, blocurile de bază ale ADN-ului și ARN-ului, o parte a ARNt constă dintr-un total de șase nucleozide modificate care nu fac parte din ADN și ARN. Nucleozidele suplimentare sunt dihidrouridină, inosină, tiouridină, pseudouridină, N4-acetilcitidină și ribotimidină.
În fiecare ramură a ARNt, se formează nucleobaze conjugate cu secțiuni cu două catenuri analoge cu ADN-ul. Fiecare ARNt poate prelua doar un anumit 20 de aminoacizi proteici cunoscuți și îl poate transporta la reticulul endoplasmic dur pentru biosinteză și îl poate face disponibil acolo. În consecință, cel puțin un ARN de transfer specializat trebuie să fie disponibil pentru fiecare aminoacid proteinogenic. În realitate există mai mult de un ARNt disponibil pentru anumiți aminoacizi.
Funcție, efect și sarcini
Sarcina principală a ARN-ului de transfer este de a permite unui aminoacid proteic specific din citosol să se atașeze de acceptorul său de aminoacizi, să-l transporte la reticulul endoplasmic și să-l atașeze acolo printr-o legătură peptidică la gruparea carboxilă a aminoacidului care a fost depus ultima dată, astfel încât proteina care este formată extins de un aminoacid.
Următorul ARNt este apoi gata din nou pentru a stoca aminoacidul „corect” conform codării. Procesele se desfășoară cu viteză mare. În eucariote, inclusiv celulele umane, lanțurile polipeptidice se prelungesc cu aproximativ 2 aminoacizi pe secundă în timpul sintezei proteice. Rata medie de eroare este de aproximativ un aminoacid la o mie. Aceasta înseamnă că aproximativ fiecare a mia parte aminoacid a fost sortată incorect în timpul sintezei proteice. Evident, în cursul evoluției, această rată de eroare a fost nivelată ca fiind cel mai bun compromis între cheltuielile de energie necesare și posibilele efecte negative ale erorilor.
Procesul de sinteză a proteinelor are loc în aproape toate celulele în timpul creșterii și pentru a sprijini restul metabolismului. ARNt poate îndeplini sarcina și funcția sa importantă de a selecta și transporta anumiți aminoacizi dacă ARNm-ul (ARN mesager) a făcut copii ale segmentelor genice corespunzătoare ale ADN-ului. Fiecare aminoacid este practic codat de secvența a trei baze nucleice, codonul sau tripleta, astfel încât cele patru baze nucleice posibile aritmetic 4 la puterea de 3 sunt egale cu 64 de posibilități. Cu toate acestea, având în vedere că există doar 20 de aminoacizi proteinogenici, unele triplete pot fi utilizate pentru control ca codoni de început sau de final. De asemenea, unii aminoacizi sunt codificați de mai multe triplete diferite.
Aceasta are avantajul că este atinsă o anumită toleranță la erori față de mutațiile punctuale, fie pentru că secvența incorectă a codonului se întâmplă să codifice același aminoacid, fie pentru că un aminoacid cu proprietăți similare este încorporat în proteină, astfel încât în multe cazuri proteina sintetizată este în cele din urmă lipsită de erori. sau funcționalitatea sa este doar puțin limitată.
Educație, apariție, proprietăți și valori optime
ARN-urile de transfer sunt prezente în aproape toate celulele în cantități diferite și compoziții diferite. Sunt codificate ca alte proteine. Diferitele gene sunt responsabile pentru modelele ARNt-urilor individuale. Genele responsabile sunt transcrise în nucleul celular din caryoplasmă, unde așa-numitele precursoare sau pre-ARNt sunt, de asemenea, sintetizate înainte de a fi transportate prin membrana nucleară în citosol.
Numai în citosolul celulei sunt pre-ARNt-urile, prin despicarea așa-numitelor introni, secvențe de bază care nu au nicio funcție pe gene și sunt purtate doar de-a lungul, dar sunt transcrise oricum. După etape suplimentare de activare, ARNt este disponibil pentru transportul unui anumit aminoacid. Mitocondriile joacă un rol special, deoarece au propriul lor ARN, care conține, de asemenea, gene care definesc genetic ARNt-urile pentru propriile nevoi. ARNt-urile mitocondriale sunt sintetizate intramitochondrial.
Datorită participării aproape universale a diferitelor ARN de transfer în sinteza proteinelor și datorită conversiilor rapide, nu se pot da valori de concentrare optime sau valori de referință cu limite superioare și inferioare. Disponibilitatea aminoacizilor corespunzători în citosol și alte enzime care sunt capabile să activeze ARNt-urile este importantă pentru funcția ARNt-urilor.
Boli și tulburări
Cele mai mari pericole pentru întreruperea funcției ARN-ului de transfer constau în lipsa furnizării de aminoacizi, în special a lipsei de aminoacizi esențiali, pe care organismul nu îi poate compensa cu alți aminoacizi sau cu alte substanțe.
În ceea ce privește tulburările reale în funcția ARNt-urilor, cel mai mare pericol constă în mutațiile genice, care intervin în anumite puncte în procesarea ARN-ului de transfer și în cel mai rău caz duc la o defecțiune funcțională a moleculei de ARNt corespunzătoare. Talasemia, o anemie care este urmărită în urma unei mutații genice în intron 1, servește ca exemplu. O mutație genică în gena care codifică intronul 2 duce, de asemenea, la același simptom. Drept urmare, sinteza hemoglobinei este sever restricționată în eritrocite, astfel încât apare o alimentare inadecvată de oxigen.



.jpg)







.jpg)
.jpg)