Proteina tropomyosin apare în principal în mușchii striați și participă la contracția musculară. Mutațiile genetice pot afecta structura moleculelor de tropomiozină produse și, prin urmare, pot provoca o serie de boli - incluzând diverse forme de cardiomiopatie, precum și congenita multiplexă cu artrogripoză și miopatia nemalin.
Ce este tropomiozina?
Tropomiozina este o proteină care se găsește în corpul uman în primul rând în mușchii scheletului. Biochimistul Kenneth Bailey a descris prima dată proteina în 1946. Un singur mușchi este format din multe mănunchiuri de fibre musculare, care la rândul lor constau din fibrele musculare.
Fiecare fibră nu este compusă dintr-o singură celulă musculară clar definită, ci dintr-un țesut cu numeroase nuclee celulare. În aceste unități, miofibrilele reprezintă fibre mai fine; secțiunile lor transversale se numesc sarcomeres. Un sarcomere este format din două tipuri de șuvițe care sunt împinse alternativ unul în altul, precum un angrenaj sau un fermoar. Unele dintre aceste catene sunt miozina, celelalte sunt un complex de actină și tropomiozină. În acest complex, moleculele de actină formează un lanț gros în jurul căruia sunt înfășurate două șuvițe de tropomiozină.
Anatomie și structură
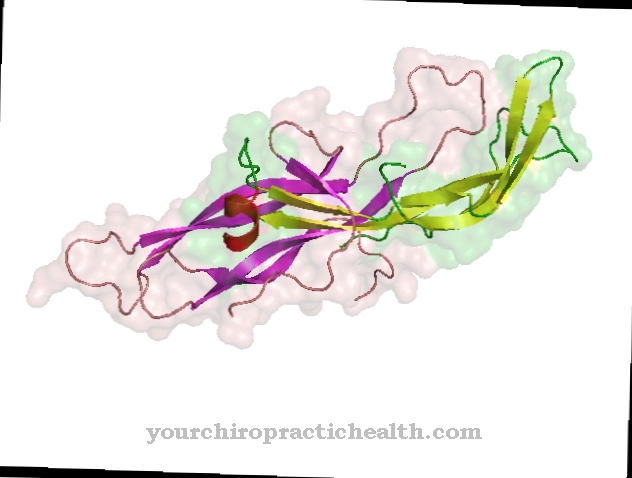
Tropomiozina este formată din două părți: α și β. Cele două blocuri de construcție au un total de 568 aminoacizi, dintre care 284 sunt α-tropomiozină și 284 sunt β-tropomiozină. Acești aminoacizi se aliniază la rând și formează lanțuri lungi înainte de a se uni în cele din urmă pentru a forma o macromoleculă în formă de tijă.
Secvența aminoacizilor și structura proteinei sunt determinate genetic; la oameni, următoarele gene sunt responsabile pentru acest lucru: TPM1 pe al 15-lea cromozom, TPM2 pe al 9-lea cromozom, TPM3 pe primul cromozom și TMP4 pe al 19-lea cromozom. Șuvița tropomiozinei (cu ambele subunități) se învârte în jurul filamentelor de actină mai groase din mușchii scheletului striați. Troponina, o altă proteină, este de asemenea atașată la ea.
Funcție și sarcini
Tropomiozina este necesară pentru a se contracta mușchiul scheletului. Când un impuls nervos ajunge în mușchi, stimulul electric se răspândește inițial prin sarcolemme și tubulii T și duce în final la eliberarea ionilor de calciu în reticulul sarcoplasmic.
Ionii se leagă temporar de troponină, care este localizată pe catena tropomiozinei. Ca urmare, ionii de calciu schimbă proprietățile fizice ale moleculei. Troponina se schimbă ușor la suprafață și se îndepărtează astfel de locurile de care se poate lega și miozina. Miozina formează fibrele complementare ale complexului actină / tropomiozină. La sfârșitul filamentului de miozină există două așa-numite capete. Capetele de miozină se pot lega de zonele filamentului de actină care nu mai sunt ocupate de troponină.
După ce s-au fixat pe fibră, capetele de miozină se pliază și se împing între filamentele de actină / tropomiozină, ceea ce scurtează sarcomerul. În același timp, acest proces se întâmplă nu doar într-un sarcomere, ci în multe. Prin urmare, numeroasele sarcomeres contractate determină fibrele musculare și, astfel, mușchiul în general. Un semnal nervos stimulează adesea câteva sute de fibre musculare. Efectul plastifiant al adenozinei trifosfat (ATP) permite capului de miozină să se detașeze de actină.
Contracția mușchilor netezi este oarecum diferită. Mușchii netezi înconjoară organele la oameni sau se găsesc în pereții vaselor de sânge. Poate contracta mai mult decât mușchii striați. În timp ce mușchii scheletului au o structură striată, mușchii netezi formează o suprafață plană formată din celule individuale. Pe lângă actină și tropomiozină, mușchii netezi au caldesmon și calmodulină, alte două proteine, a căror interacțiune influențează tensiunea din mușchi. Tropomiozina acționează în primul rând asupra calmodulinei.
În plus, tropomiozina joacă, de asemenea, un rol în alte procese biologice. De exemplu, pare să influențeze legarea actinei în citoschelet și să aibă un efect asupra diviziunii celulare.
boli
O boală care poate fi legată de tropomiozină este cardiomiopatia hipertrofică. Aceasta este o boală de inimă în care sarcomerele (secțiuni ale fibrelor musculare) sunt îngroșate, ceea ce afectează și grosimea fibrelor musculare în ansamblu.
Ca urmare, pot apărea simptome precum senzația de presiune în piept, amețeli, respirație, sincopă și atacuri de angină. În acest caz, ei revin la probleme funcționale ale mușchiului cardiac. Cea mai frecventă cauză (40–60%) a cardiomiopatiei hipertrofice constă în gene: modificările (mutațiile) duc la erori în codul genetic și, în consecință, la sinteza incorectă a proteinelor. Acest lucru poate afecta, de asemenea, diferitele proteine care alcătuiesc fibrele musculare.
În cardiomiopatia restrictivă, mușchiul cardiac se întărește. Cauza este un exces de țesut conjunctiv. Cardiomiopatia restrictivă duce la insuficiență cardiacă, care este caracterizată de obicei prin tulburări de respirație, edem, tuse uscată, oboseală, epuizare, amețeli, sincopă, palpitații și diverse tulburări digestive. Cei afectați sunt mai puțin susceptibili să fie confundați, suferă de probleme de memorie sau de performanțe cognitive deteriorate. Cardiomiopatia dilatată se poate datora și unei erori la genele tropomiozinei.
Când această boală cardiacă se manifestă, este adesea asociată cu insuficiență cardiacă globală și / sau insuficiență cardiacă progresivă stângă. În plus, pot apărea tulburări de respirație, embolii și aritmii cardiace. Alte două boli care pot fi legate de tropomiozină și care se bazează parțial pe mutații sunt miopatia nemalinului, în care mușchii pot fi afectați în multe feluri, și artrogripoza congenită multiplexă, în care articulațiile se rigidizează. Cu toate acestea, toate aceste boli pot avea și alte cauze; mutațiile din genele tropomiozinei sunt o singură posibilitate.








.jpg)