transtiretină este o proteină de transport pentru hormonii tiroidieni care se găsește la toate vertebrele.este sintetizată în ficat și în anumite zone ale creierului. Modificările genetice specifice ale transtireretinei pot duce la amiloidoza tip 1 sau amiloidoza ATTR.
Ce este transtiretina?
Transtireretină (TTR) aparține proteinelor de transport. În plus față de globulina care leagă tiroxina (TBG), este și o proteină care leagă hormonii tiroidieni. Cu toate acestea, forța sa de legare nu este la fel de puternică ca cea a TBG.
L-tiroxina (T4) este 99,99 la sută și triiodotironina (T3) de cel puțin 99 la sută legată de TBG. Transtireretina se leagă de hormonul tiroidian T4 cu o afinitate mai mică. La T3 nu există nicio legătură. Legătura cu proteinele de transport crește timpul de înjumătățire a hormonilor tiroidieni în organism considerabil, deoarece excreția lor prin urină este întârziată semnificativ. Timpul de înjumătățire pentru T4 este de aproximativ cinci până la opt zile. La T3, cu toate acestea, este doar aproximativ 19 ore, deoarece legarea sa la TBG este mult mai mică și nu este deloc legată de transtiretină.
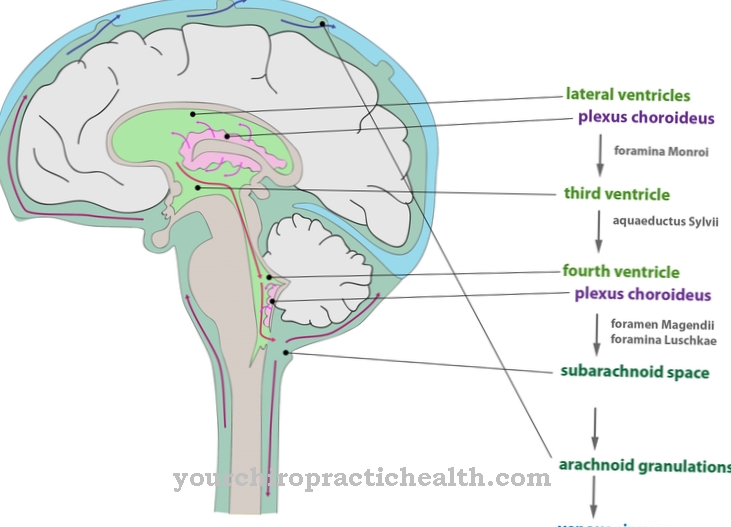
Concentrația totală a hormonilor tiroidieni depinde de concentrația proteinelor de transport. Cu toate acestea, spre deosebire de hormonii tiroidieni liberi, hormonii tiroidieni legați nu sunt activi biologic. Principalele locuri de producție pentru transtiretină sunt ficatul și plexul coroid. Plexul coroid este o structură vasculară arteriovenoasă încâlcită în ventriculele cerebrale.
Anatomie și structură
Transtireretina este o moleculă proteică care constă din 127 de aminoacizi. Structura sa secundară, terțiară și cuaternară este compusă din homotetramere. Proteina de transport poate fi determinată cu ajutorul electroforezei serice. Apare înainte de vârful albuminelor, motiv pentru care transtireretina este și denumirea alternativă Prealbumin adus în.
Transtireretina are o masă molară de 55 kDa. Structura chimică a transtireretinei îi permite să se lege de hormonii tiroidieni și de retinol. Deoarece concentrația sa scade în reacțiile inflamatorii cronice, este cunoscută și ca proteină anti-acută în fază. Proteinele în fază acută sunt produse în mare măsură în reacțiile inflamatorii. În acest fel, acestea sunt rapid disponibile organismului în cazul reacțiilor de apărare necesare. Dimpotrivă, este valabil pentru proteinele anti-acute, cum ar fi transtiretina.
Funcție și sarcini
Principala funcție a transtireretinei este de a lega și transporta hormonii tiroidieni. Împreună cu TBG, asigură timpul său de înjumătățire mai lung în organism. Hormonii tiroidieni sunt inactivi atunci când sunt legați, dar pot fi eliberați în orice moment, dacă este necesar.
O altă funcție a transtireretinei este legarea de retinol. Formează complexe cu proteina care leagă retinolul. Retinolul este vitamina A gratuită, care își asumă o varietate de sarcini în organism. Este responsabil pentru procesul vizual și participă la funcția pielii, a mucoaselor, a sistemului imunitar, a metabolismului și a celulelor sanguine. Atât hormonii tiroidieni, cât și retinolul sunt active doar sub formă liberă. Cu toate acestea, legarea lor la molecule de transport, cum ar fi transtiretina, previne reacțiile necontrolate ale acestor substanțe active. Eliberarea controlată din legătura cu proteinele de transport asigură că aceste substanțe funcționează corect.
boli
Diverse mutații ale transtireretinei pot provoca deficiența acesteia, precum și o legătură mai puternică cu hormonii tiroidieni (hipertiroxinemie). În hipertiroxidinemie, valorile totale ale glandei tiroide sunt crescute. Dar concentrația hormonilor tiroidieni liberi este normală.
În consecință, funcția tiroidiană normală are loc. Nu există simptome. Hipertiroidemia este uneori confundată cu hipertiroidismul (glanda tiroidă hiperactivă). Diferența este însă că hipertiroidismul are atât o concentrație totală crescută a tiroidei, cât și o concentrație mai mare de hormoni tiroidieni liberi. Cu toate acestea, în legătură cu transtiretina, apare amiloidoza de tip 1 (amiloidoza TTR). Adesea este rezultatul lipsei de transtiretină, care la rândul său este genetică.
În amiloidoză, fibrele proteice mici care nu mai sunt solubile sunt depuse în spațiile dintre celule, interstițiu. Aceste fibre au forma unor așa-numite fibrilele beta numite amiloid. Amiloidoza nu este o boală independentă, ci este un termen colectiv pentru mai multe boli diferite cu procese de depunere patologică.În funcție de cauză, anumite organe sunt afectate de depunerea fibrelor proteice defecte. Amtiloidoza TTR cauzată de transtiretină poate implica inima, sistemul nervos, intestinele, ochii, plămânii sau rinichii, printre altele.
Este posibilă insuficiența cardiacă cu aritmie cardiacă, tulburări senzoriale la nivelul mâinilor și picioarelor, diaree, constipație, pierdere în greutate sau, în cazuri rare, leziuni renale severe până la dializă inclusiv. Deoarece transtireretina este produsă în ficat, un transplant de ficat poate vindeca această formă de amiloidoză. Noul ficat sănătos sintetizează din nou transtiretina normală. Procesul de depunere se oprește. Cu toate acestea, dacă boala este mai avansată, un transplant de ficat nu mai poate garanta o cură. O formă specială de amiloidoză TTR este amiloidoza ATTR (amiloidoza senilă). Această formă a bolii apare în special la bătrânețe. Tot aici, cauza se regăsește în modificările genetice ale transtireinei.
Dacă este lăsată netratată, amiloidoza duce la moarte în câțiva ani. Pe lângă un transplant de ficat cauzal, trebuie efectuate terapii simptomatice. Acestea depind de organele care sunt afectate în special. Dacă inima este implicată, se administrează diuretice și inhibitori de ACE. Dacă apar aritmii cardiace, un stimulator cardiac poate fi de ajutor. Este important să mâncați o dietă cu un nivel scăzut de săruri. Dacă sunt implicați rinichii, este indicată și o dietă săracă, inhibitori de ACE și diuretice. Dializa poate fi necesară.









.jpg)
.jpg)
.jpg)
.jpg)
.jpg)