miozina aparține proteinelor motorii și este responsabil, printre altele, pentru procesele implicate în contracția musculară. Există diferite tipuri de miozine, toate participând la procesele de transport ale organelelor celulare sau la schimbări în citoschelet. Abaterile structurale ale structurii moleculare a miozinei pot fi, în anumite circumstanțe, cauzele bolilor musculare.
Ce este miozina?
Alături de dyneină și kinezină, miozina este una dintre proteinele motorii care sunt responsabile pentru procesele de mișcare a celulelor și procesele de transport în interiorul celulei. Spre deosebire de celelalte două proteine motorii, miozina funcționează doar cu actină. La rândul său, actina face parte din citoscheletul celulei eucariote. Prin urmare, este responsabil pentru structura și stabilitatea celulei.
Mai mult, actina cu miozina și alte două proteine structurale formează unitatea structurală contractilă reală a mușchiului. Două treimi din proteinele contractile din mușchi sunt miozine și o treime sunt actina. Cu toate acestea, miozinele nu sunt prezente numai în celulele musculare, ci și în toate celelalte celule eucariote. Aceasta se aplică eucariotelor unicelulare, precum și celulelor vegetale și animale. Microfilamentele (filamente de actină) sunt implicate în structura citoscheletului din toate celulele și, împreună cu miosina, controlează curenții protoplasmici.
Anatomie și structură
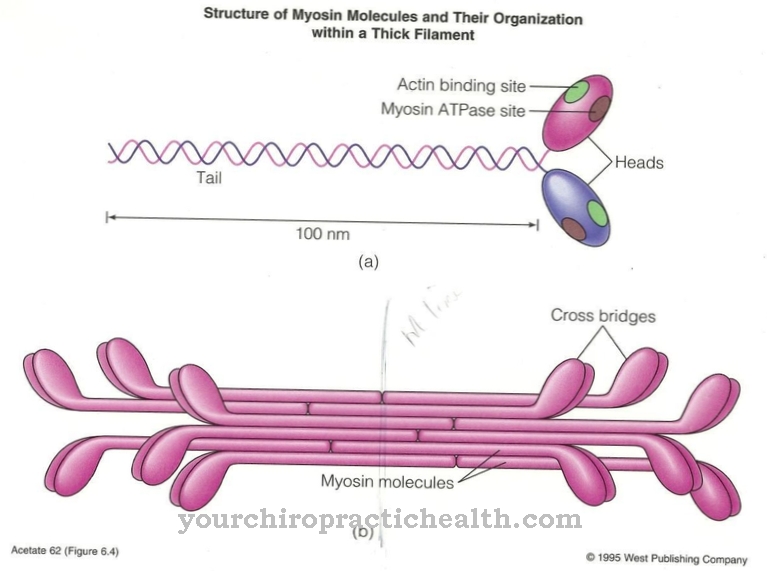
Miozinele pot fi împărțite în clase și subclase diferite. În prezent, sunt cunoscute peste 18 clase diferite, clasele I, II și V fiind cele mai importante. Miozina care se găsește în fibra musculară se numește miozină convențională și aparține clasei II. Structura tuturor miozinelor este similară. Toate constau dintr-o parte a capului (capul de miozină), o parte a gâtului și o parte a cozii.
Filamentele de miozină din mușchiul scheletului constau din aproximativ 200 de molecule de miozină II, fiecare având o greutate moleculară de 500 kDa. Titlul este foarte conservator din punct de vedere genetic. Divizarea în clase structurale este determinată în principal de variabilitatea genetică a părții cozii. Partea capului se leagă de molecula de actină, în timp ce partea de gât acționează ca o balamală. Piesele de coadă ale mai multor molecule de miozină se acumulează și formează filamente (mănunchiuri). Molecula de miozină II este formată din două lanțuri grele și patru lanțuri ușoare.
Cele două lanțuri grele formează un așa-numit dimer. Cel mai lung dintre cele două lanțuri are o structură alfa-helix și este format din 1300 de aminoacizi. Lanțul mai scurt este format din 800 de aminoacizi și reprezintă așa-numitul domeniu motor.Este partea capului a moleculei, care este responsabilă de mișcări și procesele de transport. Cele patru lanțuri ușoare sunt conectate la capul și gâtul lanțurilor grele. Lanțurile ușoare aflate mai departe de cap sunt denumite regulatoare, iar lanțurile ușoare apropiate de cap ca lanțuri esențiale. Sunt foarte afini de calciu și pot astfel controla mobilitatea părții gâtului.
Funcție și sarcini
Cea mai importantă funcție a tuturor miozinelor este de a transporta organulele celulare în celulele eucariote și de a efectua schimbări în citoschelet. Moleculele convenționale de miozină II, împreună cu actina și proteinele tropomiozină și troponină, sunt responsabile de contracția musculară. Pentru a face acest lucru, miozina este mai întâi integrată în discurile Z ale sacomerului folosind proteina titină. Șase filamente de titină fixează un filament de miozină.
În sacomer, un filament de miozină se formează în jur de 100 de conexiuni încrucișate cu părțile laterale. În funcție de structura moleculelor de miozină și de conținutul de mioglobină, se pot distinge mai multe forme de fibre musculare. Contracția musculară are loc în interiorul sacomerului datorită mișcării miozinei în ciclul cross-bridge. În primul rând, capul de miozină este fixat ferm de molecula de actină. Apoi ATP este împărțit în ADP, prin care energia eliberată duce la tensiunea capului de miozină. În același timp, lanțurile ușoare asigură o creștere a ionilor de calciu. Acest lucru face ca capul de miozină să se atașeze de o moleculă de actină vecină, ca urmare a unei schimbări conformaționale.
Prin eliberarea vechii conexiuni, tensiunea este acum transformată în energie mecanică printr-un așa-numit impact de forță. Mișcarea este similară cu un accident vascular cerebral. Capul de miozină se înclină de la 90 de grade la între 40 și 50 de grade. Rezultatul este mișcarea musculară. În timpul contracției musculare, numai lungimea sacomerului este scurtată, în timp ce lungimile filamentelor de actină și miozină rămân aceleași. Alimentarea cu ATP în mușchi este suficientă doar pentru aproximativ trei secunde. Prin descompunerea glucozei și a grăsimilor, ADP este transformat în ATP, astfel încât energia chimică poate fi transformată în energie mecanică.
boli
Modificările structurale ale miozinei cauzate de mutații pot duce la boli musculare. Un exemplu de astfel de boală este cardiomiopatia hipertrofică familială. Cardiomiopatia hipertrofică familială este o boală ereditară care este moștenită ca trăsătură dominantă autosomală. Boala se caracterizează printr-o îngroșare a ventriculului stâng fără dilatare.
Cu o prevalență de 0,2 la sută în populația generală, este o boală cardiacă relativ frecventă. Această boală este cauzată de mutații care duc la modificări structurale ale betamiozinei și alfaropropiozinei. Aceasta nu este una, ci mai multe mutații punctuale ale proteinelor implicate în structura sacomerului. Majoritatea mutațiilor sunt localizate pe cromozomul 14. Patologic, boala se manifestă ca o îngroșare a mușchilor din ventriculul stâng.
Această asimetrie a grosimii mușchiului cardiac poate duce la apariția unor afecțiuni cardiovasculare cu aritmii cardiace, respirație, amețeli, pierderea cunoștinței și angină pectorală. Deși mulți pacienți au insuficiență cardiacă mică sau deloc, poate apărea insuficiență cardiacă progresivă.

.jpg)








.jpg)
.jpg)
.jpg)
.jpg)
.jpg)