Sinteza hemoglobinei este compus din sinteza hemo și sinteza globinei. În cele din urmă, grupul protetic de heme, fiecare cu patru globine, este legat de hemoglobina complexă proteică care conține fier. Tulburările atât în sinteza hemei cât și în sinteza globinei pot duce la probleme grave de sănătate.
Ce este sinteza hemoglobinei?

Pentru a înțelege sinteza hemoglobinei, este necesară mai întâi cunoașterea structurii hemoglobinei. Hemoglobina este un complex proteic care conține fier, care este format din patru subunități de globină, fiecare cu un grup protetic de heme.
La hemoglobina umană adultă există două globine alfa identice, precum și două globine beta identice ca subunități. Fiecare dintre aceste subunități este legată de o grupare protetică hemo, care constă dintr-un complex de fier de porfirină (II). Astfel, un complex de hemoglobină conține patru grupe heme.
În funcție de mediul chimic, fiecare grupă heme poate lega o moleculă de oxigen la ionul feroz într-o manieră complexă. În funcție de câte grupe heme sunt încărcate cu oxigen, se vorbește despre oxihemoglobină (bogată în oxigen) sau dezoxihemoglobină (cu un nivel scăzut de oxigen).
Ionul feroz este situat în mijlocul inelului de porfirină. În lateral există o legătură complexă la reziduul de histidină al globinei. Pe de altă parte, în funcție de starea energetică a ionului de fier, o moleculă de oxigen poate fi legată într-un complex. Starea energetică este influențată de condițiile fizice și chimice externe datorate modificărilor conformației globinei.
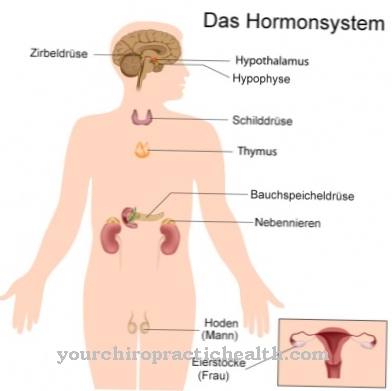
Funcție și sarcină
Ultima etapă în sinteza hemoglobinei constă în asamblarea grupului de heme protetice cu cele patru unități de globină pentru a forma un complex proteic care conține fier. Componentele individuale sunt formate din căi biosintetice independente.
Materialele de pornire pentru inelul de porfirină al grupei heme sunt aminoacizii glicină și succinil-CoA. Succinil-CoA este compus din coenzima A și acid succinic. Acidul succinic este un produs intermediar în defalcarea corpurilor cetonice bogate în energie, ca parte a metabolismului energetic. Cu ajutorul enzimei delta-aminolevulinice acid sintaza, acidul delta-aminolevulinic este sintetizat din succinil-CoA și glicină. Două molecule de acid delta-aminolevulinic se condensează cu eliminarea unei molecule de apă pentru a forma derivatul de pirol porfobilinogen. Odată cu eliminarea amoniacului și cu ajutorul enzimei uroporfirinogen-I sintaza, patru molecule de porfobiliogen reacționează formând hidroximetilbilan. Acesta este transformat în uroporfirinogen III cu formare de inele.
Protoporfirina este produsă prin decarboxilarea enzimatică și deshidratarea în mitocondrii. Cu enzima ferrochelatază, un ion de fier (II) este încorporat în această moleculă cu formarea de heme. În citosolul celulei, hemeul este legat de proteina globină pentru a forma hemoglobina complexului proteic care conține fier.
Sinteza globinelor individuale are loc prin biosinteza proteică normală. Așa cum am menționat deja, complexul de hemoglobină adultă conține două subunități identice de alfa și beta-globine. Datorită structurii sale complexe, hemoglobina finită a dezvoltat capacitatea de a transporta oxigenul și de a-l furniza tuturor celulelor organismului.
Cu toate acestea, legarea fierului central de oxigen nu este foarte strânsă și poate fi ușor influențată de factori chimici și fizici externi. Aceasta permite ca hemoglobina să absoarbă și să elibereze rapid oxigenul. Conținutul de oxigen al hemoglobinei depinde, printre altele, de factorii pH, dioxid de carbon sau presiune sau temperatură parțială a oxigenului. Aceste variabile care influențează schimbă, de exemplu, conformitatea globinelor, astfel încât legătura de oxigen poate fi întărită sau slăbită prin ușoare modificări în condițiile energetice și sterice.
Cu o valoare scăzută a pH-ului și o presiune parțială ridicată de dioxid de carbon, legătura de oxigen la ionul de fier (II) este slăbită și, astfel, este favorizată eliberarea de oxigen. Exact în aceste condiții are loc o cifră de afaceri metabolică mai puternică, care are și o cerere crescută de oxigen. Prin urmare, sistemul de transport al oxigenului este coordonat optim cu nevoile fizice prin intermediul funcției de hemoglobină.
Boli și afecțiuni
Tulburările în sinteza hemoglobinei pot duce la diverse boli. Există o serie de boli genetice care se bazează pe întreruperea sintezei de heme. În acest proces, precursorii heme se acumulează în corp, care duc, printre altele, la o sensibilitate extremă la lumină. În aceste așa-numite porfirie, porfirinele sunt depozitate în vasele de sânge sau chiar în ficat. Când sunt expuse la lumină, unele forme de porfirie stochează mai multă energie de radiație. Când energia este eliberată, se creează radicali de oxigen care atacă și distrug țesutul expus. Aceasta duce la mâncărime severă și dureri arzătoare.
Există șapte forme de porfirie. Construcția hemei este un proces în opt etape în care sunt implicate șapte enzime. Dacă o enzimă funcționează inadecvat, precursorul respectiv este stocat în acest moment în sinteza hemeului. Pe baza simptomelor, porfirile sunt împărțite în două grupe principale. Așa-numitele porfirie cutanate se caracterizează prin sensibilitatea dureroasă a pielii la lumină.În porfiriile hepatice, afectarea ficatului predomină cu dureri abdominale severe, greață și vărsături. În multe cazuri, însă, există o suprapunere între cele două complexe de simptome.
Porfirie prezintă adesea un curs intermitent cu atacuri acute. În funcție de tipul de porfirie, acestea se manifestă în reacții cutanate brusc dureroase, dureri abdominale colioase, greață / vărsături, colorarea roșie a urinei, convulsii, deficite neurologice sau chiar psihoze.
Alte tulburări de sinteză a hemoglobinei se referă la sinteza defectuoasă a moleculelor de globină prin mutații în genele corespunzătoare. Exemple sunt așa-numitele anemii cu celule secera sau talasemie. În anemia cu celule secera, proteina subunității beta globinei este modificată genetic. În poziția șase a acestei proteine, aminoacidul acid glutamic a fost înlocuit cu valină. Dacă lipsește oxigenul, hemoglobina în cauză devine în formă de secera, se aglomerează și înfundă mici vase de sânge. Aceasta duce la tulburări circulatorii care pot pune viața în pericol. Talasemiile sunt un grup de malformații diferite ale hemoglobinei care duc la formarea redusă a lanțului globinei de alfa sau beta globină. Anemia severă este cel mai important simptom.












.jpg)