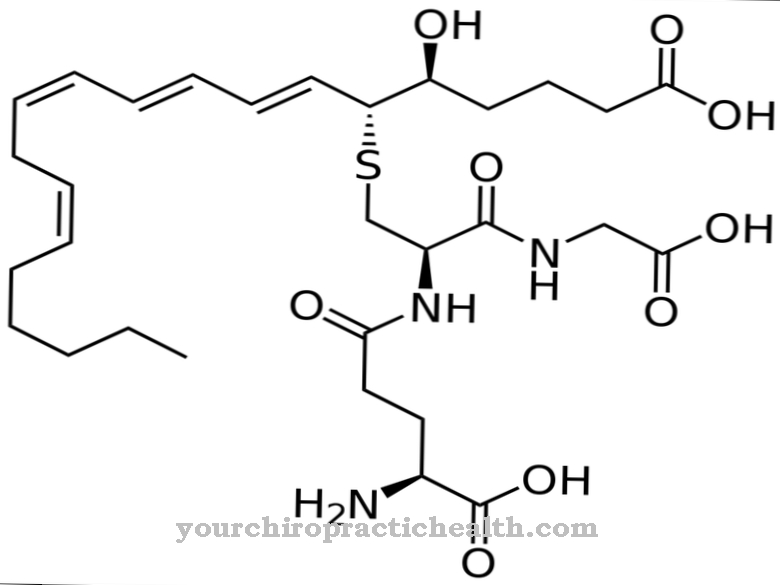
Desmosin este un aminoacid proteinogen. Împreună cu alți aminoacizi, formează fibra și proteina structurală elastină. Cu mutații în gena ELN, structura elastinei este perturbată.
Ce este desmosin?
Aminoacizii sunt o parte importantă a organismului uman. Sunt o clasă de compuși organici care sunt formați din cel puțin o grupare carboxi și o grupă amino. Aminoacizii sunt prin urmare atât acizi carboxilici cât și amine.
În funcție de poziția lor în raport cu grupa carboxxi, aminoacizii pot fi asociați diferitelor grupări. Aminoacizii cu o grupare carboxi terminală sunt numiți geminal sau α și se numără printre α-aminoacizi. Acești aminoacizi sunt elemente ale proteinelor. Corpul uman are peste 20 de aminoacizi proteinogenici și 400 de aminoacizi neproteogenici. D-aminoacizii sunt un grup special. Unul dintre cei peste 20 de aminoacizi proteinogeni este desmosina, care împreună cu izodesmosina construită în mod similar formează elastina proteinei din fibre.
Elastina și tropoelastina precursoare solubilă aparțin proteinelor structurale și contribuie la conturarea și reținerea structurilor anatomice. Elastina joacă un rol special în capacitatea vaselor mari de sânge de a se întinde, de exemplu aorta.
Funcție, efect și sarcini
Desmosin este formal un aminoacid cvadruplu. Are un inel piridinic în centru. Piridina este un compus chimic cu formula empirică C5H5N, care poate fi atribuită sistemelor parente heterociclice și formează cea mai simplă azină sub forma unui inel cu șase membri cu un atom de azot și cinci atomi de carbon.
Datorită inelului său central de piridiniu, desmosina poate rețea firele proteice individuale din fibra de proteină elastină. Compoziția elastinei este similară cu cea a colagenului. În loc de hidroxilizină, însă, elastina are o proporție semnificativă de valină. Reziduurile de lizină sunt oxidate la allysine de enzima lisil oxidază. Trei aliline și o lizină la rândul lor formează o desmosină sub formă de inel. Această formă joacă un rol semnificativ în elasticitatea unei molecule întregi de elastină.
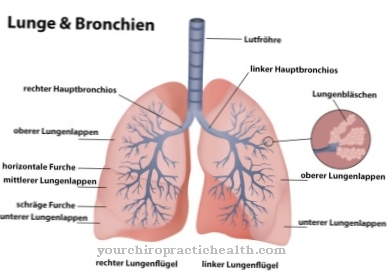
Ca o rețea de proteine, elastina este formată din unități legate de desmosină și este extensibilă elastic. Plămânii, precum și pielea și vasele de sânge sunt dependente de elastină și de componenta sa desmosin, deoarece aceasta este singura modalitate prin care obțin elasticitatea lor considerabilă. Desmosin fluorează albastru sub lumina UV și conferă elastinei culoarea galbenă, insolubilitatea sa în apă, stabilitatea căldurii și rezistența la alcaline și proteaze.
Educație, apariție, proprietăți și valori optime
Formarea desmosinei este cunoscută și sub denumirea de biosinteză de desmosină. În timpul acestei biosinteze, grupările amino terminale ale unităților L-lizinei sunt transformate în ω-aldehide de către enzima lisil oxidază prin oxidare.
Lisil oxidaza este o proteină lizină 6 oxidază și corespunde astfel unei enzime care apare în spațiul extracelular al țesutului conjunctiv. În legătura încrucișată de elastină și colagen, servește ca catalizator și stabilizator mecanic pentru proteine. În timpul biosintezei desmosinei, lisiloxidaza transformă lizina în alizină. Acest proces are loc în matricea extracelulară și stabilizează legăturile încrucișate dintre colagen și elastină. Din punct de vedere chimic, reacția corespunde dezaminării oxidative pentru a forma aldehida. Allysine formează fie allysinaldol, fie desmosina cu reziduuri de aldehidă ale moleculelor vecine de tropelastină printr-o condensare de aldol.
Restul lizinei formează o bază Schiff prin grupa sa amino și creează izodesmosină. Pe lângă vasele de sânge, plămânii și pielea, toate microfibrilele poartă în special desmosină. Acestea sunt cele mai mici fibre de țesut colagen, reticular și elastic.
Boli și tulburări
Formarea elastinei din componente precum desmosin este perturbată în diferite boli. Aceste boli includ în principal mutații ale genei ELN. Cele mai importante dintre acestea sunt dermatochalazia, sindromul Williams-Beuren și stenoza aortică congenitală subvalvulară. Dermatochalasis este un grup de modificări ale țesutului conjunctiv cu acumularea familială.
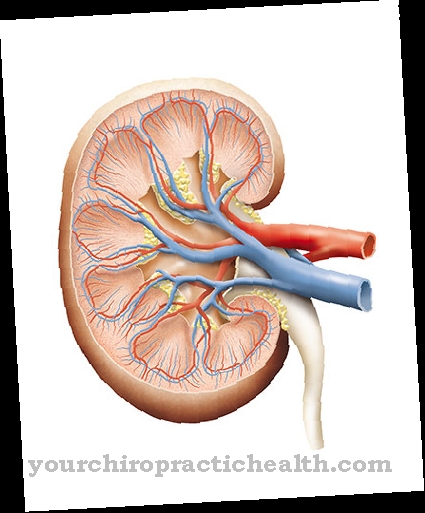
Caracteristic pentru acest grup este pielea înfiorătoare, mai puțin elastică și mai ridată pe diverse părți ale corpului. Gena ELN codează elastina și poate provoca astfel de simptome printr-o mutație. Sindromul Williams-Beuren este destul de rar comparativ cu acesta, afectând doar unul din 20.000 de nou-născuți. Boala este cauzată de un defect pe cromozomul șapte. Locul genei este 7q11.23. Din cauza unui defect în acest moment, persoanei afectate îi lipsește gena de elastină și genele învecinate. Ștergerea genei elastinei provoacă dismorfism facial și tulburări în structura organului intern. Pot apărea defecte cardiace, cum ar fi stenoza aortică supravalvulară și malformații renale, cum ar fi rinichiul de potcoavă sau stenoza vasculară renală. În plus, există adesea un handicap cognitiv.
Abilitățile mentale ale celor afectați sunt sub medie. În ciuda expresivității verbale, ele formează mai ales propoziții cu puțin conținut. Încep să citească la o vârstă extrem de fragedă, care de multe ori supraestimează abilitățile lor mentale. Pe lângă hiperlexia lor, tonul lor perfect duce adesea la supraestimări. Ca o formă de mutație a elastinei, stenoza aortică congenitală subvalvulară corespunde la rândul ei unei malformații cardiace asociate cu îngustarea arterei majore. Stenoza supravalvulară se află peste valva aortică la începutul aortei.
Această formă a defectului cardiac este adesea caracterizată de constricții în formă de clepsidră care se află deasupra ieșirii vaselor coronare. Partea ascendentă a aortei poate fi, de asemenea, îngustată. Această formă de stenoză aortică apare în special în contextul sindromului Williams-Beuren care a fost discutat. Acest defect cardiac a fost deja observat indiferent de boală. În acest caz, totuși, nu trebuie să fie neapărat legată de o mutație a genei elastinei.




.jpg)
-eisenmangelanmie.jpg)





.jpg)