Tripsină Ca o enzimă a pancreasului, este responsabilă pentru defalcarea suplimentară a proteinelor alimentare. Funcționează în gama puternic alcalină. Deficitul de tripsină duce la deficiență de proteine în organism din cauza digestiei afectate de proteine.
Ce este tripsina?
Trypsina este o protează care continuă descompunerea proteinelor din zona alcalină a intestinului subțire. În stomac, descompunerea proteinelor începe în mediul acid de către enzima pepsină. Trypsina enzimatică este formată din trei componente.
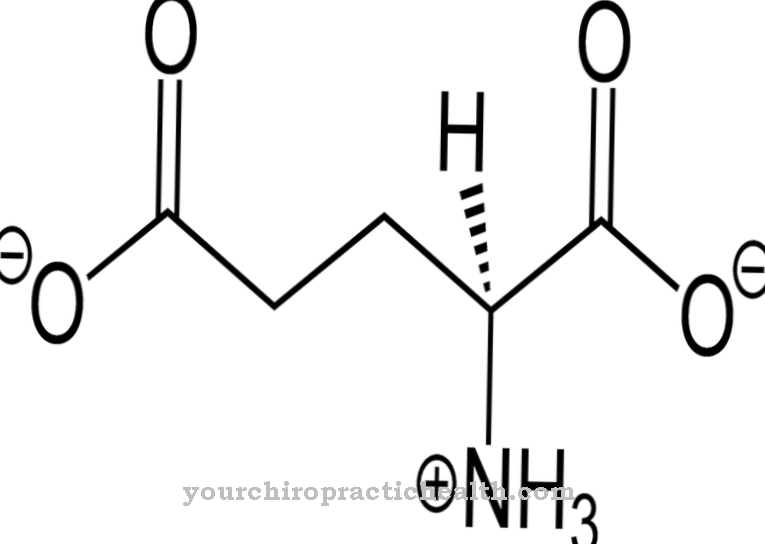
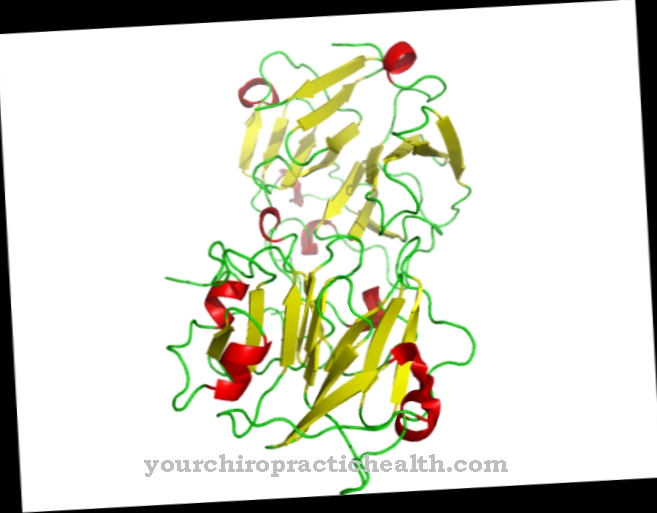
Acestea sunt trypsin-1 ca cation, trypsin-2 ca anion și trypsin-4. Două treimi din enzimă constă din trypsină-1 și o treime din trypsină-2. Trypsina-4 sau mezotripsina se găsește numai în cantități mici. Trypsina este o endoproteză. Divizează doar o proteină în anumite locuri. Este, de asemenea, o serin protează. Centrul său activ conține triada catalitică de acid aspartic, histidină și serină. Împărțește proteinele dietetice în mod preferențial la aminoacizii de bază lizină, arginină și cisteină modificată.
Trypsina este produsă din precursorul zimogenului trypsinogen cu ajutorul acțiunii catalitice a enzimei intestinale enteropeptidaza. Enzima este formată din 224 aminoacizi. Trypsin își dezvoltă efectul optim la o valoare de pH de 7 până la 8.
Funcție, efect și sarcini
Sarcina trypsinei este de a continua defalcarea proteinelor care au început deja în stomac în gama alcalină. În stomac, pre-digerarea proteinelor alimentare de către enzima similară pepsină începe în intervalul acid.
Tot aici, lanțurile de proteine sunt rupte în anumite puncte. În timp ce această împărțire a proteinelor are loc în stomac pe aminoacizi aromatici, cum ar fi fenilalanina, proteinele și polipeptidele sunt împărțite prin trypsină pe aminoacizii de bază lizină și arginină, precum și pe cisteina modificată. O altă diferență față de pepsină este că trypsina își dezvoltă efectul optim în domeniul alcalin la o valoare de pH de 7 până la 8. Trypsina activată transformă, de asemenea, alți zimogeni, cum ar fi chimotripsinogenul, pro-elastaza, procarboxipeptidaza și alte enzime inactive în enzime active.
Conversia începe imediat după eliberarea de tripsină. Celelalte proteaze ale pancreasului sunt chimotripsina, carboxipeptidaza sau elastina. Mai mult, trypsina se activează prin transformarea trypsinogenului. Enzimele pancreatice sunt inițial în forma lor inactivă pentru a nu descompune pancreasul prin auto-digestie. Doar când secretele preformelor inactive pot fi activate prin divizare. În primul rând, conversia trypsinogenului în tripsină este catalizată de enteropeptidaza. Aceasta este singura funcție a enteropeptidazei.
Un hexamer cu aminoacid terminal terminal este despicat de trypsinogen. Deoarece trypsina se desparte și de lanțurile polipeptidice pe lizina de bază, acum catalizează și propria activare și, în același timp, activarea celorlalți zimogeni. Împreună cu enzimele chimotripsină și elastază, împarte proteinele mai mari în intestinul subțire și peptonele (lanțuri polipeptidice) produse prin acțiunea pepsinei în tri- și dipeptide. Aceste peptide mai mici sunt apoi defalcate mai departe în aminoacizi cu ajutorul altor enzime. În special, tripsina contribuie de asemenea la descompunerea aminoacidului metionină. Lizina stimulează, printre altele, formarea de tripsină.
Educație, apariție, proprietăți și valori optime
Trypsina este o enzimă endogenă care este utilizată pentru digerarea proteinelor alimentare. De aceea, este întotdeauna secretat de pancreas la scurt timp după mâncare. Cu toate acestea, enzima poate fi obținută și din surse animale și utilizată medicamentos. Efectul de împărțire a proteinelor poate fi folosit, printre altele, pentru a descompune complexele proteice ale organismului. Astfel se pot rezolva complexele imune în bolile autoimune.
Inflamarea în sistemul musculo-scheletic poate fi, de asemenea, tratată bine cu tripsină. De asemenea, activează enzima plasmină din plasminogen. Plasmina dizolvă fibrina atunci când există o formare puternică de tromb. Cu ajutorul tripsinei, tromboza poate fi tratată sau chiar prevenită. Mai mult, trypsina susține digestia atunci când este luată în timpul meselor. Când se aplică cu 1 până la 2 ore înainte sau după masă, își desfășoară efectele antiinflamatorii.
Boli și tulburări
În contextul insuficienței pancreatice, sinteza enzimelor digestive precum trypsina poate fi restricționată. Consecința este dezvoltarea indigestiei. Pe lângă proteaze, pancreasul produce și lipaze și amilaze.
Dacă lipsește enzimele, componentele alimentare nu mai sunt digerate și ajung în colon. De exemplu, dacă lipsește tripsina, proteina din dietă nu mai poate fi digerată corect. Bacteriile putrefactive se instalează în intestinul gros și descompun proteinele în mod anaerob. Există probleme digestive masive cu flatulență, diaree și dureri abdominale. Mai mult, formarea redusă de aminoacizi duce la o deficiență de proteine și malnutriție, în ciuda aportului alimentar suficient. Cu toate acestea, enzimele pot fi furnizate și din exterior.
Cu toate acestea, există și urgențe medicale în care enzimele proprii ale organismului, cum ar fi tripsina, digerează pancreasul în sine. Acest lucru se poate întâmpla dacă canalele biliare și pancreatice sunt blocate. Trypsina este eliberată, dar nu poate intra în intestinul subțire prin blocajul pancreatic. Dacă nu este deschisă canalul pancreatic în această situație acută de urgență, rezultatul va fi fatal din cauza auto-dizolvării pancreasului. Chiar și în cazul tumorilor pancreatice, canalul pancreatic poate fi închis complet sau parțial. Acțiunea sucurilor digestive din interiorul pancreasului se manifestă sub formă de pancreatită cronică sau acută.
Lipsa de tripsină poate fi cauzată și de o mutație. Există, de asemenea, forme ereditare de pancreatită atunci când descompunerea tripsinei este perturbată.






.jpg)





.jpg)