Lysiloxidaza este o enzimă a țesutului conjunctiv care are sarcini catalitice și promovează reticularea colagenului și a elastinei. Enzima are un efect stabilizator asupra țesutului conjunctiv prin efectuarea deaminării oxidative și creând astfel condițiile de bază pentru reticularea. În Cutis laxa, activitatea lisiloxidazei este redusă.
Ce este lisiloxidaza?
Există diferite enzime în corpul uman, toate având activitate catalitică. Enzimele permit reacțiile din corpul uman sau le accelerează. Lisiloxidaza este o enzimă care se găsește în țesutul conjunctiv uman. Se mai numește proteină lizină 6 oxidază și se găsește mai ales în spațiul extracelular al țesutului conjunctiv.
Activitatea catalitică a enzimei în acest caz se referă la reticularea dintre colagen și elastină. Lisiloxidaza stabilizează cele două proteine într-un mod mecanic și permite conectarea reactivă. Lisiloxidaza nu se găsește numai în corpul uman. Alte vertebrate sunt, de asemenea, echipate cu enzimă. Lysil oxidaza este considerată a fi un stabilizator al țesutului conjunctiv. O deficiență de enzimă duce la tabloul clinic al cutis laxa, o slăbiciune severă și ereditară a țesutului conjunctiv.
Funcție, efect și sarcini
Lisiloxidaza ocupă sarcini importante în spațiul extracelular în conexiunea încrucișată între moleculele individuale de colagen. În corpul uman, colagenul joacă un rol major în cadrul proteinelor, cu aproximativ 30 la sută din masa proteică totală.
Colagenul este cea mai frecventă proteină. Este o proteină structurală și de construcție care alcătuiește multe părți ale corpului, cum ar fi țesutul conjunctiv, oasele, dinții, cartilajul, tendoanele, ligamentele și pielea. Lysil oxidaza susține legarea colagenului de grupările carbonil și contribuie astfel la stabilitatea componentelor corpului menționate. Are activitate catalitică pentru producerea de grupări carbonilice care formează legături încrucișate covalente pe colageni în condensările aldolului. Sarcina catalitică a lisil oxidazei este, prin urmare, pregătirea pentru formarea fibrilelor. Enzima creează toate condițiile chimice necesare formării.
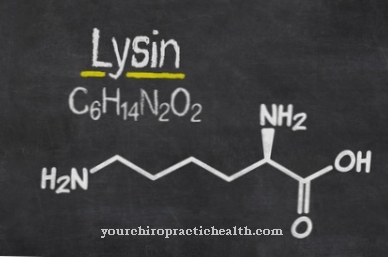
Fibrele sunt considerate fibre din fibre. Ele corespund unor părți subțiri și fibroase ale corpului și se găsesc în pereții celulelor vegetale, în mușchii umani și în țesutul conjunctiv. Sarcina lisil oxidazei în acest context este în esență deaminarea oxidativă a reziduurilor de lisil. În chimie, dezaminarea este divizarea chimică a grupărilor amino ca ioni de amoniu sau amoniac. Deaminarea oxidativă împarte grupările amino ale aminoacidului L-glutamat de hidrogen și le oxidează în grupări imino cu transferul de hidrogen în NAD + sau NADP +.
Aceasta este urmată de clivarea hidrolitică a grupărilor imino ca ioni de amoniu, care este asociată cu formarea acidului α-ceto. Deaminarea corespunde primului pas în descompunerea biochimică a aminoacizilor, care la mamifere are loc în principal în ficat. Ionul de amoniu format în timpul dezaminării este transformat în uree. Procesele de dezaminare ale lisil oxidazei dau naștere grupărilor de aldehidă care, împreună cu grupările amino individuale ale altor reziduuri de lizil, dau naștere la așa-numitele baze ale lui Schiff și în acest fel pot forma legăturile încrucișate din colagen.
Educație, apariție, proprietăți și valori optime
Lisiloxidaza din ADN este codificată de gena LOX, care la om este localizată pe cromozomul 5 în gena locus q23.3 până la q31.2. Produsul genic nu este forma finală a enzimei. Produsul nu este o lizilxidază finită, ci o formă predecesoare care, după traducere, are o masă molară de 47 kDa.
Glicozilarea are loc în cursul următor. În acest proces, masa molară a enzimei ulterioare crește la 50 kDa și forma anterioară de lisil oxidază este secretată în spațiul extracelular. După secreție, pre-pro-lisil oxidaza este prelucrată în continuare. Substanța este împărțită în spațiul extracelular. Proteina 1 este responsabilă de împărțirea în două fragmente.În acest fel, pe de o parte, se produce lizila oxidază de 32 kDa. Pe de altă parte, se creează o substanță reziduală, care în acest caz corespunde unui polipeptid.
Boli și tulburări
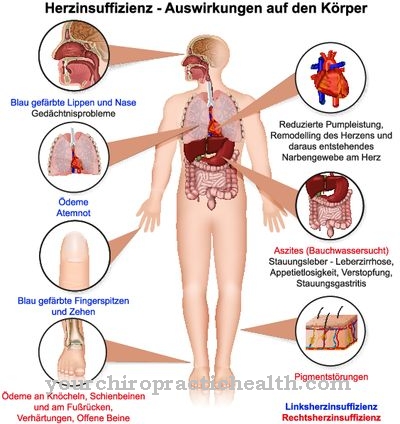
Defectele genetice ale lisil oxidazei pot provoca tabloul clinic al cutixului laxe. Această boală se mai numește dermatochalaze și se referă la un grup de slăbiciuni legate adesea de vârstă a țesutului conjunctiv, care în majoritatea cazurilor se observă cu acumulare familială.
Caracteristica obișnuită a tuturor fenomenelor dermatochalazelor este pielea înfundată și inelastică, care de multe ori atârnă în pliuri mari pe diverse părți ale corpului. Majoritatea celor afectați arată mai în vârstă decât sunt din cauza modificărilor. Bolile sunt cauzate, printre altele, de mutații genetice. În acest context, vorbim despre sindromul cutis laxa. Boala poate exista în forme autosomale recesive, autosomale dominante și x-cromomomale. În multe cazuri, sindromul cutis laxa este asociat cu alte anomalii și, dacă sunt implicate organele, de exemplu, poate fi fatal.
ARCL1 corespunde unei cutis laxa de tip recesiv autosomal de tip 1 și este considerată a fi cea mai severă formă, care în anumite circumstanțe poate duce la complicații care pot pune viața în pericol. Forma ARCL1A este asociată cu mutații ale genei FBLN5 la locus 14q32.12. Tipul ARCL1B este asociat cu mutații ale genei EFEMP2 la locus 11q13.1, iar varianta ARCL1C corespunde unei cutis laxa cu anomalii însoțitoare la nivelul plămânului, gastrointestinalului și tractului urinar, care se datorează mutațiilor din gena LTBP4 la locus 19q13.2.
Mutațiile din genele menționate duc la o activitate sub medie a lixoloxidazei. Conexiunile încrucișate inadecvate sunt create datorită activității reduse a enzimei. Țesutul conjunctiv al pacientului nu este suficient de stabilizat.









.jpg)